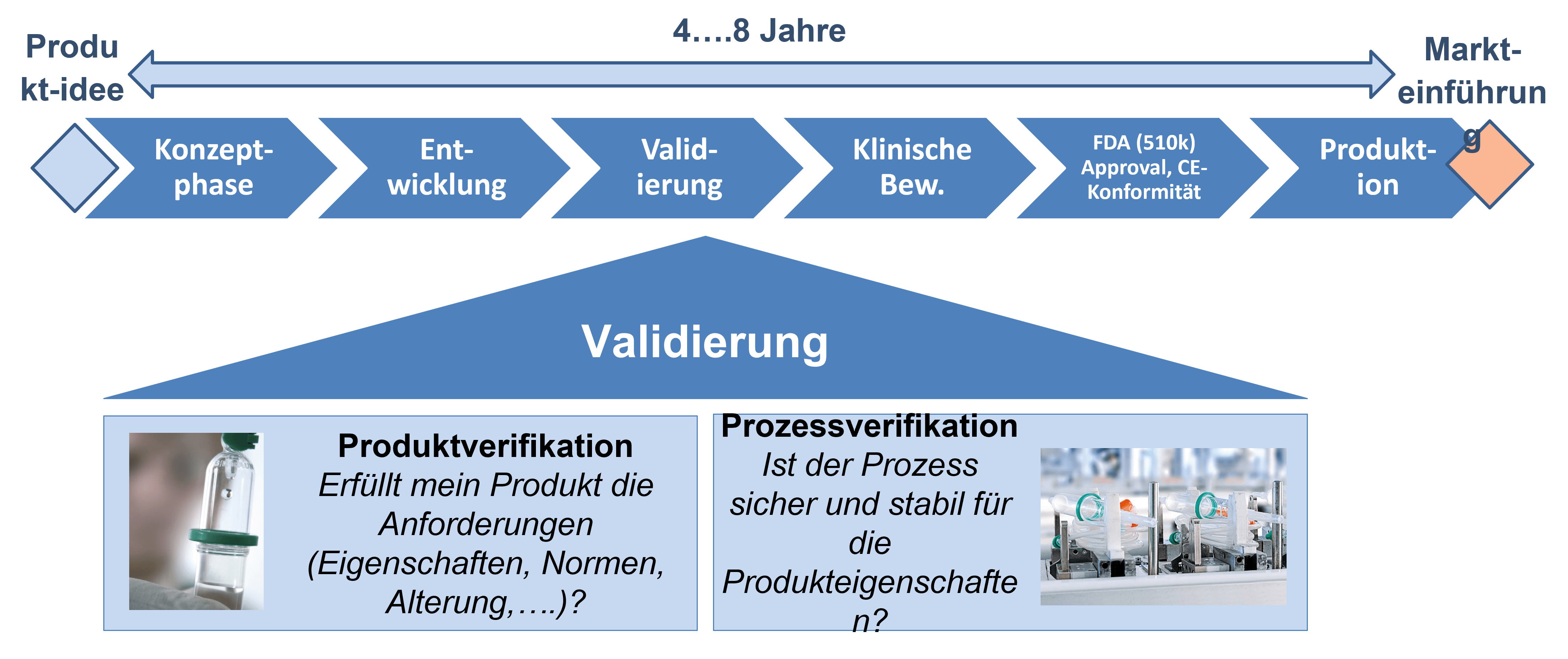
Internationale Regelwerke, wie die erst kürzlich im Hinblick auf erhöhte Anforderungen an Patientensicherheit überarbeitete Medizinprodukteverordnung MDR 2017/745 [MDR17] der Europäischen Union fordern eine Validierung der Herstellprozesse im Rahmen des Entwicklungsprozesses. Durch die MDR 2017/745 ist die Sicherheit als grundlegende Leistungsanforderung für das Medizinprodukt als essentiell definiert. Auf Anforderungen an eine Validierung des Prozesses wird nicht explizit eingegangen. Für die Technische Dokumentation, speziell für die Informationen zur Auslegung und Herstellung, fordert die Verordnung jedoch „vollständige Informationen und Spezifikationen einschließlich der Herstellungsprozesse und ihrer Validierung, der verwendeten Hilfsstoffe, der laufenden Überwachung und der Prüfung des Endprodukts.“ (MDR 2017/745, Anh. II, Pkt. 3b). Weiterführende Erläuterungen zur Validierung werden offengelassen. Standards zur Beschreibung von Qualitätsmanagementsystemen für Medizinprodukte wie die ISO 13485 [ISO16] führen hingegen den Begriff der Validierung weiter aus:
„Die Organisation muss sämtliche Prozesse der Produktion und Dienstleistungserbringung validieren, deren Ergebnis nicht durch nachfolgende Überwachung oder Messung verifiziert werden kann oder verifiziert wird, wodurch sich Unzulänglichkeiten erst zeigen, nachdem das Produkt in Gebrauch genommen oder die Dienstleistung erbracht worden ist.“ (ISO 13485, Pkt. 7.5.6 Validierung der Prozesse zur Produktion und Dienstleistungserbringung).
Zu der gleichen Einschätzung kommt auch der Erfahrungsaustauschkreis der nach dem Medizinproduktegesetz benannten Stellen (EK-Med), ein nationales Gremium der Zentralstelle der Länder für Gesundheitsschutz bei Arzneimitteln und Medizinprodukten. Als zu validierende Prozesse werden Sterilisationsprozesse, Reinigungsprozesse, aseptische Abfüllung, Verpackungsprozesse für Sterilprodukte, Beschichtungsprozesse, Spritzguss, Löten, Kleben, Schweißen benannt [EKM07].
Es ist erkennbar, dass eine Validierung des Prozesses prinzipiell gefordert ist, auf explizite Vorgaben zur Validierung verzichten die Regelwerke aber bewusst und legen diese in die Hände des Inverkehrbringers. Einen ersten Lösungsansatz zur Validierung speziell für den Verarbeitungsprozess Spritzgießen will das AiF-Projekt „ValiData“ liefern. Das Institut für Kunststoffverarbeitung (IKV) Aachen untersucht zurzeit im Rahmen einer industriellen Gemeinschaftsforschung Methoden zur Validierung von Spritzgießprozessen für die Medizintechnik durch Strategien der Prozessregelung [AIF20].
Die Hersteller von Medizinprodukten haben mittlerweile eigene Strategien und Ansätze zur Validierung, angepasst auf ihre Produkte und Herstellprozesse entwickelt und mit den Benannten Stellen abgestimmt. Die ist eine branchenübliche individuelle Vorgehensweise, die aber auch daraus resultiert, dass Standards und Richtlinien zur Orientierung bisher für diese Thematik nicht vorhanden sind.
Insbesondere klein- und mittelständisch geprägte Inverkehrbringer oder Komponentenhersteller, die für verschiedene Inverkehrbringer als Lieferant agieren, sehen sich aber vor dem Hintergrund der wachsenden Anforderungen an die Prozessvalidierung großen Herausforderungen gegenüberstehen. Gilt es doch, die eigenen Herstellprozesse entsprechend zu organisieren und einen regelwerkkonformen Validierungsprozess zu etablieren. Eine Prozessvalidierung beansprucht zeitliche als auch kapazitive Ressourcen. Sie muss zum richtigen Zeitpunkt eingeplant und berücksichtigt werden. Nicht zu unterschätzen ist der dokumentarische Aufwand, der mit einer Validierung verbunden ist. Unterschiedliche Sichtweisen über die Inhalte und die Vorgehensweisen im Rahmen einer Validierung zwischen Kunden und Lieferanten sorgen mitunter nicht nur für Reibungsverluste und Unfrieden im Projektablauf, sie können sogar zu einer erheblichen zeitlichen Verzögerung führen.
Der Bedarf an einer Rahmenrichtlinie für Kunststoffverarbeitungsprozesse wurde durch den VDI-Facharbeitskreises „Kunststoffe in der Medizintechnik“ erkannt. Im April 2021 wurde das VDI-Richtlinienvorhaben 2023 „Validierung von Kunststoffverarbeitungsprozessen für die Medizintechnik – ProValiMed“ ins Leben gerufen. Ziel ist die Erarbeitung eines Leitfadens, der Leitplanken für die Validierung für Herstellprozesse von Kunststoffkomponenten vorgibt. Dies soll insbesondere den Komponentenherstellern ermöglichen, eigene Validierungsprozesse darauf aufbauend zu konzipieren. Im Fokus der Richtlinie steht der Spritzgießprozess, wobei die Richtlinie aber auch auf andere Kunststoffverarbeitungsprozesse wie Extrusion, Folienherstellung, Schweißprozesse angewendet werden kann. So soll es auch für bisher branchenfremde Hersteller möglich sein, die eigenen Prozesse entsprechend auf die Anforderungen der Medizintechnik auszurichten, um in der Branche Fuß zu fassen. Ein weiterer wichtiger Aspekt ist, dass die Kunden auf diese Leitplanken referenzieren können. Oftmals ist der Inverkehrbringer kein Experte im Kunststoffverarbeitungsprozess. Muss er ja auch nicht sein. Für beide Seiten gilt es daher, die Anforderungen zu erfüllen, aber auch nicht aufgrund von Unwissenheit unnötig über das Ziel hinauszuschießen.
Der Arbeitskreis besteht aus rund 25 Vertreterinnen und Vertretern von Inverkehrbringern, Herstellern von Kunststoffkomponenten, Hochschulen und Maschinenherstellern sowie Expertinnen und Experten aus der statistischen Datenanalyse. Gemeinsam wurde im letzten Jahr damit gestartet, die Struktur der Richtlinie zu konzipieren und Stück für Stück mit Inhalten zu füllen. Durch die Richtlinie werden die verschiedenen Aspekte der Validierung für den Komponentenhersteller und Inverkehrbringer adressiert.